EQUASYM
La compañía biofarmacéutica Shire lanza en España Equasym, indicado como parte de un programa de tratamiento integral del trastorno por déficit de atenciónHiperactividad en niños a partir de 6 años1
La compañía biofarmacéutica Shire anuncia el lanzamiento de Equasym (metilfenidato hidrocloruro, cápsulas duras de liberación modificada), tras su aprobación por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) para el tratamiento del TDAH (Trastorno por Déficit de Atención e Hiperactividad).
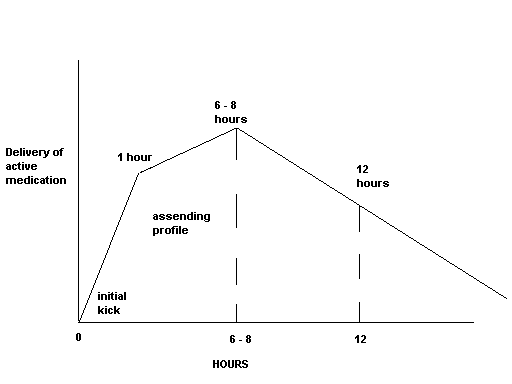
Equasym, cuyo principio activo es Metilfenidato, consta de un componente de liberación inmediata (30% de la dosis) y un componente de liberación modificada(70% de la dosis); está diseñado para proporcionar niveles plasmáticos terapéuticos durante un periodo de aproximadamente 8 horas, lo que coincide con la jornada escolar, por ello estamos ante otra presentación del metilfenidato, que en mi opinión por su duración esta equiparable al medikinet.
En mi expericencia profesional he visto que para algunos pacientes es mejor usar diferentes presentaciones, por ejemplo he visto pacientes con metabolizacion lenta que el concerta le produce insonio, y por el contrario con medikinet, o ahora con Equasym, por la mañana y un Rubifen por la tarde completa el horario de trabajo sin afectar al sueño.
Os adjunto la ficha tecnica del producto segun VADEMECUM, pues creo que poco mas se puede decir de esta nueva presentación de metilfenidato
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Equasym 10 mg cápsulas: Cada cápsula contiene 10 mg de metilfenidato hidrocloruro que corresponde a 8,65 mg de metilfenidato. Excipientes con efecto conocido: sacarosa (45 mg/cápsula).
Equasym 20 mg cápsulas: Cada cápsula contiene 20 mg de metilfenidato hidrocloruro que corresponde a 17,30 mg de metilfenidato. Excipientes con efecto conocido: sacarosa (90 mg/cápsula).
 Equasym 30 mg cápsulas: Cada cápsula contiene 30 mg de metilfenidato hidrocloruro que corresponde a 25,94 mg de metilfenidato. Excipientes con efecto conocido: sacarosa (135 mg/cápsula).
Equasym 30 mg cápsulas: Cada cápsula contiene 30 mg de metilfenidato hidrocloruro que corresponde a 25,94 mg de metilfenidato. Excipientes con efecto conocido: sacarosa (135 mg/cápsula).
Cápsula dura de liberación modificada.
Equasym 10 mg cápsulas: la cápsula tiene una tapa opaca verde oscura con “S544” impreso en blanco y un cuerpo opaco blanco con “10 mg” impreso en negro.
Equasym 20 mg cápsulas: la cápsula tiene una tapa opaca azul con “S544” impreso en blanco y un cuerpo opaco blanco con “20 mg” impreso en negro.
Equasym 30 mg cápsulas: la cápsula tiene una tapa opaca marrón rojiza con “S544” impreso en blanco y un cuerpo opaco blanco con “30 mg” impreso en negro.
DATOS CLÍNICOS
Indicaciones Terapéuticas de EQUASYM Cáps. dura de liberación modificada 30 mg
 Trastorno por déficit de atención-hiperactividad (TDAH). Metilfenidato está indicado como parte de un programa de tratamiento integral del trastorno por déficit de atención-hiperactividad (TDAH) en niños a partir de 6 años cuando otras medidas por sí mismas han demostrado ser insuficientes. El tratamiento debe estar bajo la supervisión de un especialista en trastornos del comportamiento en niños. El diagnóstico debe realizarse de acuerdo con los criterios DMS-IV o las directrices de la ICD-10 y debe estar basado en la historia y evaluación completas del paciente. No se puede establecer el diagnóstico únicamente con la presencia de uno o más síntomas. Se desconoce la etiología específica de este síndrome, y no existe una única prueba diagnóstica. Para un diagnóstico adecuado es necesario recurrir a la psicología clínica y especializada, y a los recursos sociales y educativos.
Trastorno por déficit de atención-hiperactividad (TDAH). Metilfenidato está indicado como parte de un programa de tratamiento integral del trastorno por déficit de atención-hiperactividad (TDAH) en niños a partir de 6 años cuando otras medidas por sí mismas han demostrado ser insuficientes. El tratamiento debe estar bajo la supervisión de un especialista en trastornos del comportamiento en niños. El diagnóstico debe realizarse de acuerdo con los criterios DMS-IV o las directrices de la ICD-10 y debe estar basado en la historia y evaluación completas del paciente. No se puede establecer el diagnóstico únicamente con la presencia de uno o más síntomas. Se desconoce la etiología específica de este síndrome, y no existe una única prueba diagnóstica. Para un diagnóstico adecuado es necesario recurrir a la psicología clínica y especializada, y a los recursos sociales y educativos.
Un programa de tratamiento completo generalmente incluye tanto medidas psicológicas, educacionales y sociales así como farmacoterapia y pretende estabilizar a los niños que padecen un síndrome de comportamiento caracterizado por síntomas que pueden incluir historia crónica de dificultad para prestar atención, fácilmente distraíbles, labilidad emocional, impulsividad, hiperactividad de moderada a severa, signos neurológicos menores y EEG anormal. La capacidad de aprendizaje puede o no deteriorarse.
El tratamiento con metilfenidato no está indicado para todos los niños con este síndrome y la decisión de usar el fármaco debe estar basada en una evaluación muy completa de la gravedad y cronicidad de los síntomas del niño en relación con su edad.
Una ubicación educativa apropiada es esencial, y suele ser necesaria la intervención psicosocial. Cuando otras medidas por sí mismas han demostrado ser insuficientes, la decisión de prescribir un estimulante debe estar basada en una rigurosa evaluación de la gravedad de los síntomas del niño. La utilización de metilfenidato siempre debe hacerse de esta manera de acuerdo a la indicación autorizada y de acuerdo a las directrices de prescripción y diagnóstico.
Posología y administración de EQUASYM Cáps. dura de liberación modificada 30 mg
Equasym consta de un componente de liberación inmediata (30% de la dosis) y un componente de liberación modificada (70% de la dosis). Por lo tanto, Equasym 10 mg proporciona una dosis de liberación inmediata de 3 mg y una dosis de liberación prolongada de 7 mg de metilfenidato hidrocloruro. La parte de liberación prolongada de cada dosis está diseñada para mantener la respuesta al tratamiento por la tarde sin tener que tomar una dosis a mediodía. Está diseñada para proporcionar niveles plasmáticos terapéuticos durante un periodo de aproximadamente 8 horas, lo que coincide con la jornada escolar en vez de durante todo el día (ver sección 5.2 “Propiedades farmacocinéticas”). Por ejemplo, 20 mg de Equasym pretende sustituir a 10 mg con el desayuno y 10 mg con la comida de metilfenidato hidrocloruro de liberación inmediata.
Niños (de 6 o más años) y adolescentes:
El tratamiento debe iniciarse bajo la supervisión de un especialista en trastornos del comportamiento en niños y/o adolescentes.
Screening pretratamiento.
Antes de prescribir, es necesario realizar una evaluación basal del estado cardiovascular del paciente, incluyendo presión arterial y ritmo cardiaco. La medicación concomitante, los trastornos o síntomas co-mórbidos médicos y psiquiátricos pasados y presentes, antecedentes familiares de muerte súbita cardíaca/inexplicada y un registro detallado de altura y peso antes del tratamiento en un gráfico de crecimiento (ver secciones 4.3 y 4.4) deben estar documentados en la historia completa.
Control continuo.
Se deben controlar continuamente el crecimiento y los estados psiquiátrico y cardiovascular (ver sección 4.4).
·El pulso y la presión sanguínea se deben registrar en una curva de percentiles en cada ajuste de dosis y después, al menos cada 6 meses;
·La altura, el peso y el apetito se deben registrar al menos cada 6 meses en una gráfica de crecimiento;
·La aparición o el empeoramiento de trastornos psiquiátricos preexistentes debe controlarse en cada ajuste de dosis y después, al menos cada 6 meses y en cada visita.
Se debe controlar a los pacientes por el riesgo de mal uso, abuso y tráfico de metilfenidato.
Ajuste de dosis:
Es necesario un ajuste de dosis cuidadoso al comenzar el tratamiento con metilfenidato. El ajuste de dosis se debe iniciar con la dosis más baja posible. Esto normalmente se consigue utilizando una formulación de liberación inmediata tomada en dosis divididas. La dosis inicial recomendada diaria es de 5 mg una vez o dos veces al día (por ej.: con el desayuno y la comida), aumentando en caso necesario en incrementos semanales de 5-10 mg en la dosis diaria según la tolerabilidad y el grado de eficacia observado. Se puede utilizar Equasym 10 mg una vez al día en vez de metilfenidato hidrocloruro de liberación inmediata 5 mg dos veces al día desde el comienzo del tratamiento cuando el médico considere que la administración dos veces al día es adecuada desde el comienzo y, sin embargo, la administración del tratamiento dos veces al día no es práctica.
La dosis máxima diaria de metilfenidato hidrocloruro es de 60 mg.
En el caso de dosis que no sean posibles/prácticas con esta concentración, hay disponibles otras concentraciones de este medicamento u otros medicamentos cuyo principio activo es metilfenidato.
Pacientes que actualmente utilizan metilfenidato: a los pacientes que reciben tratamiento establecido con una formulación de metilfenidato hidrocloruro de liberación inmediata se les puede cambiar a la dosis diaria equivalente en miligramos de Equasym. Equasym no se debe tomar demasiado tarde por la mañana ya que puede ocasionar alteraciones del sueño. Si el efecto del medicamento desaparece demasiado pronto avanzada la tarde, podría reaparecer una alteración del comportamiento y/o incapacidad para dormir. Una pequeña dosis de un comprimido de metilfenidato hidrocloruro de liberación inmediata avanzado el día podría ayudar a resolver este problema. En ese caso, se podría considerar la posibilidad de conseguir un control adecuado de los síntomas con un régimen de metilfenidato de liberación inmediata dos veces al día. Se deben tener en cuenta las ventajas y los inconvenientes de una pequeña dosis de metilfenidato de liberación inmediata por la tarde frente a los problemas para dormir.
En caso de necesitar una dosis adicional tardía de metilfenidato de liberación inmediata, no se debe continuar el tratamiento con Equasym, a menos que se sepa que la misma dosis adicional sería también necesaria con un régimen convencional de liberación inmediata con dosis equivalentes con el desayuno/comida. Se debe utilizar el régimen que consiga un control satisfactorio de los síntomas con la dosis total diaria más baja.
Equasym se debe administrar por la mañana antes del desayuno. Las cápsulas se pueden tragar enteras con la ayuda de líquidos o, de forma alternativa, se puede abrir la cápsula y verter el contenido sobre una pequeña cantidad (una cucharada) de compota de manzana, y tomar inmediatamente, sin guardar para usar más adelante. Después de tomar la compota de manzana con el contenido vertido, se debe beber líquido, como agua. Las cápsulas y el contenido de la cápsula no se deben triturar ni masticar.
Utilización a largo plazo (más de 12 meses) en niños y adolescentes:
La seguridad y eficacia del uso a largo plazo de metilfenidato no se ha evaluado de forma sistemática en estudios controlados. El tratamiento con metilfenidato no debe ser y no es necesario que sea indefinido. El tratamiento con metilfenidato generalmente se suspende durante o después de la pubertad. El médico que decida utilizar metilfenidato durante períodos prolongados (más de 12 meses) en niños y adolescentes con TDAH debe realizar evaluaciones periódicas de la utilidad del fármaco a largo plazo para ese paciente, manteniendo períodos de prueba sin medicación para evaluar el funcionamiento del paciente sin farmacoterapia. Se recomienda que metilfenidato se suspenda temporalmente al menos una vez al año para evaluar el estado del niño (preferiblemente durante las vacaciones escolares). Puede ocurrir que la mejoría se mantenga al suspender temporal o permanentemente el fármaco.
Reducción de la dosis e interrupción del tratamiento.
Si los síntomas no mejoran después de un ajuste de dosis apropiado durante un período de un mes, se debe suspender el tratamiento. Si se observa un empeoramiento paradójico de los síntomas o aparecen otros efectos adversos graves, se debe reducir la dosis o suspender la administración.
Adultos.
El metilfenidato no está autorizado para su uso en adultos con TDAH. No se ha establecido la seguridad y eficacia en este grupo de edad.
Pacientes de edad avanzada.
Metilfenidato no debe utilizarse en pacientes de edad avanzada. No se ha establecido la seguridad y eficacia en este grupo de edad.
Niños menores de 6 años.
Metilfenidato no debe utilizarse en niños menores de 6 años de edad. No se ha establecido la seguridad y eficacia en este grupo de edad.
Contraindicaciones de EQUASYM Cáps. dura de liberación modificada 30 mg
Equasym está contraindicado en pacientes con:
·Hipersensibilidad conocida al metilfenidato o a alguno de los excipientes (incluidos en la sección 6.1);
·Glaucoma;
·Feocromocitoma;
·Durante el tratamiento con inhibidores irreversibles no selectivos de la monoaminooxidasa, o en los 14 días posteriores a la suspensión del tratamiento con estos fármacos, por el riesgo de crisis hipertensivas (ver sección 4.5.);
·Hipertiroidismo o tirotoxicosis;
·Diagnóstico o antecedentes de depresión grave, anorexia nerviosa/ trastornos de anorexia, tendencias suicidas, síntomas psicóticos, trastornos de humor graves, manía, esquizofrenia, trastorno de la personalidad psicopático/borderline;
·Diagnóstico o antecedentes de trastorno bipolar (afectivo) grave y episódico (Tipo I) (que no está bien controlado);
·Trastornos cardiovasculares preexistentes incluyendo hipertensión grave, insuficiencia cardíaca, enfermedad arterial oclusiva, angina, enfermedad cardíaca congénita hemodinámicamente significativa, cardiomiopatías, infarto de miocardio, arritmias potencialmente mortales y canalopatías (trastornos provocados por la disfunción de los canales iónicos);
·Trastornos cerebrovasculares preexistentes, aneurisma cerebral, anomalías vasculares incluyendo vasculitis o apoplejía.
Advertencias y Precauciones de EQUASYM Cáps. dura de liberación modificada 30 mg
El tratamiento con metilfenidato no está indicado en todos los niños con TDAH y la decisión de usar el fármaco debe basarse en una evaluación muy completa de la gravedad y cronicidad de los síntomas en relación con la edad de los niños.
Uso a largo plazo (más de 12 meses) en niños y adolescentes.
La seguridad y eficacia del uso de metilfenidato a largo plazo no se ha evaluado de forma sistemática en estudios controlados. El tratamiento con metilfenidato no debe ser y no es necesario que sea indefinido. El tratamiento con metilfenidato generalmente se suspende durante o después de la pubertad. Se debe controlar cuidadosamente y de forma continua a los pacientes con terapia a largo plazo (es decir, más de 12 meses) de acuerdo a las directrices de las secciones 4.2 y 4.4 en cuanto al estado cardiovascular, crecimiento, apetito, aparición o empeoramiento de trastornos psiquiátricos preexistentes. Los trastornos psiquiátricos que hay que controlar se describen a continuación e incluyen (pero no se limitan a estos) tics motores y vocales, comportamiento agresivo u hostil, agitación, ansiedad, depresión, psicosis, manía, delirios, irritabilidad, falta de espontaneidad, pérdida y exceso de perseverancia.
El médico que decida utilizar metilfenidato durante períodos prolongados (más de 12 meses) en niños y adolescentes con TDAH debe realizar evaluaciones periódicas de la utilidad del fármaco a largo plazo para ese paciente, manteniendo períodos de prueba sin medicación para evaluar el funcionamiento del paciente sin farmacoterapia. Se recomienda que metilfenidato se suspenda al menos una vez al año para evaluar el estado del niño (preferiblemente durante las vacaciones escolares). Puede ocurrir que la mejoría se mantenga al suspender temporal o permanentemente el fármaco.
Uso en adultos.
El metilfenidato no está autorizado para su uso en adultos con TDAH. No se ha establecido la seguridad y eficacia en este grupo de edad.
Uso en pacientes de edad avanzada.
Metilfenidato no debe utilizarse en pacientes de edad avanzada. No se ha establecido la seguridad y eficacia en este grupo de edad.
Uso en niños menores de 6 años.
Metilfenidato no debe utilizarse en niños menores de 6 años. No se ha establecido la seguridad y eficacia en este grupo de edad.
Estado cardiovascular.
Los pacientes a los que se está considerando administrar un tratamiento con estimulantes deben tener una historia detallada (incluyendo una evaluación de antecedentes familiares de muerte súbita cardíaca o inexplicada o arritmia maligna) y un examen físico para evaluar la presencia de trastornos cardiacos, y deben someterse a evaluaciones cardíacas especializadas posteriores si los hallazgos iniciales sugieren estos antecedentes o trastornos. Los pacientes que desarrollen síntomas como palpitaciones, dolor opresivo en el pecho, síncope sin explicación, disnea u otros síntomas que sugieran un trastorno cardiaco durante el tratamiento con metilfenidato deben someterse a una evaluación cardíaca especializada inmediata.
El análisis de los datos de ensayos clínicos con metilfenidato en niños y adolescentes con TDAH mostró que los pacientes que utilizan metilfenidato pueden experimentar de forma frecuente cambios en la presión arterial diastólica y sistólica de más de 10 mmHg respecto a los del grupo control. Se desconocen las consecuencias clínicas a corto y largo plazo de estos efectos cardiovasculares en niños y adolescentes, pero, por los efectos observados en los datos de ensayos clínicos, no se puede descartar la posibilidad de complicaciones clínicas. Se recomienda precaución al tratar a pacientes cuyo estado médico subyacente se pueda ver afectado por el aumento de la presión arterial o de la frecuencia cardíaca. Ver sección 4.3 para ver en qué afecciones está contraindicado el tratamiento con metilfenidato. Se debe vigilar cuidadosamente el estado cardiovascular. La presión sanguínea y el pulso se deben registrar en una curva de percentiles en cada ajuste de dosis y, después, al menos cada 6 meses. La utilización de metilfenidato está contraindicada en ciertos trastornos cardiovasculares preexistentes, a menos que se disponga de una recomendación de un especialista cardiaco pediátrico (ver sección 4.3 ‘Contraindicaciones’).
Muerte súbita y anomalías cardíacas estructurales preexistentes u otros trastornos cardiacos graves.
Se ha notificado muerte súbita asociada al uso de estimulantes del sistema nervioso central a las dosis habituales en niños, algunos de los cuales tenían anomalías cardíacas estructurales u otros problemas cardiacos graves. Aunque algunos problemas cardiacos serios pueden aumentar por sí mismos el riesgo de muerte súbita, no se recomienda el uso de medicamentos estimulantes en niños o adolescentes con anomalías cardíacas estructurales conocidas, cardiomiopatía, anomalías graves del ritmo cardiaco, u otros problemas cardiacos graves que puedan suponer un aumento de la vulnerabilidad a los efectos simpaticomiméticos de un medicamento estimulante.
Mal uso y acontecimientos cardiovasculares.
El mal uso de los estimulantes del sistema nervioso central puede estar asociado con muerte súbita y otros efectos adversos cardiovasculares graves.
Trastornos cerebrovasculares.
Ver sección 4.3 para las afecciones cerebrovasculares en las que está contraindicado el tratamiento con metilfenidato. Se debe evaluar en cada visita los signos y síntomas neurológicos de los pacientes con otros factores de riesgo (tales como antecedentes de enfermedad cardiovascular, medicamentos concomitantes que aumenten la presión sanguínea) después de empezar el tratamiento con metilfenidato.
La vasculitis cerebral parece ser una reacción idiosincrásica a la exposición de metilfenidato muy rara. Hay poca evidencia para sugerir que se puede identificar a los pacientes con mayor riesgo y la aparición inicial de los síntomas puede ser el primer indicador de un problema clínico subyacente. El diagnóstico temprano, basado en un alto índice de sospecha, puede permitir una rápida retirada del metilfenidato y un rápido inicio de tratamiento. Por lo tanto, se debe considerar este diagnóstico en cualquier paciente que desarrolle nuevos síntomas neurológicos que encajen con un cuadro de isquemia cerebral durante el tratamiento con metilfenidato. Estos síntomas, pueden incluir dolor de cabeza grave, entumecimiento, debilidad, parálisis y problemas con la coordinación, la visión, el habla, el lenguaje o la memoria. El tratamiento con metilfenidato no está contraindicado en pacientes con hemiplejia cerebral.
Trastornos psiquiátricos.
La comorbilidad de los trastornos psiquiátricos en TDAH es frecuente y se debe tener en cuenta al prescribir medicamentos estimulantes. En el caso de que aparezcan síntomas psiquiátricos nuevos o empeoren los trastornos psiquiátricos preexistentes, no se debe administrar metilfenidato a menos que los beneficios superen los riesgos para el paciente. El desarrollo o el empeoramiento de los trastornos psiquiátricos se deben controlar en todos los ajustes de dosis y después, al menos cada 6 meses y en todas las visitas; puede ser adecuado interrumpir el tratamiento.
Empeoramiento de síntomas psicóticos o maníacos preexistentes.
En pacientes psicóticos, la administración de metilfenidato puede empeorar los síntomas de los trastornos de comportamiento y del pensamiento.
Aparición de nuevos síntomas psicóticos o maniacos.
La aparición de nuevos síntomas psicóticos (alucinaciones visuales/táctiles/auditivas y delirios) o maniacos en niños y adolescentes sin una historia previa de enfermedad psicótica o manía pueden deberse al uso de metilfenidato a las dosis habituales. Si aparecen síntomas maniacos o psicóticos, se debe considerar una posible relación causal con metilfenidato y puede ser adecuado suspender el tratamiento.
Comportamiento agresivo u hostil.
El tratamiento con estimulantes puede causar la aparición o el empeoramiento de agresividad u hostilidad. Se debe controlar de cerca a los pacientes tratados con metilfenidato por la aparición o empeoramiento del comportamiento agresivo u hostilidad al inicio del tratamiento, en cada ajuste de dosis y después, al menos cada 6 meses y en cada visita. Los médicos deben evaluar la necesidad de un ajuste de la pauta posológica en los pacientes que presenten cambios de comportamiento, teniendo en cuenta que puede ser apropiado aumentar o reducir la dosis. Se puede considerar la interrupción del tratamiento.
Tendencia suicida.
Los pacientes en los que aparezca una ideación o comportamiento suicida durante el tratamiento para el TDAH deben ser evaluados inmediatamente por su médicos. Se debe tener en consideración el empeoramiento de un problema psiquiátrico subyacente y una posible relación causal con el tratamiento con metilfenidato. Puede ser necesario tratar un problema psiquiátrico subyacente y se debe valorar una posible interrupción de metilfenidato.
Tics.
Metilfenidato está asociado a la aparición o empeoramiento de tics motores y verbales. También se ha notificado el empeoramiento del síndrome de Tourette. Se deben evaluar los antecedentes familiares, y una evaluación clínica de los tics o del síndrome de Tourette en los niños debe preceder al uso de metilfenidato. Se debe controlar con regularidad a los pacientes por la aparición o empeoramiento de los tics durante el tratamiento con metilfenidato. El control debe hacerse en cada ajuste de dosis y después, al menos cada 6 meses o en cada visita.
Ansiedad, agitación o tensión.
El metilfenidato está asociado con el empeoramiento de ansiedad, agitación o tensión preexistentes. La evaluación clínica de la ansiedad, agitación o tensión se debe hacer antes de utilizar metilfenidato y se debe controlar con regularidad a los pacientes por la aparición o empeoramiento de estos síntomas durante el tratamiento, en cada ajuste de dosis y después, al menos cada 6 meses o en cada visita.
Formas de trastorno bipolar.
Se debe tener especial cuidado al usar metilfenidato para tratar el TDAH en pacientes con trastorno bipolar comórbido (incluyendo el Trastorno Bipolar Tipo I no tratado u otras formas de trastorno bipolar) por el riesgo de una posible precipitación de un episodio maniaco o mixto en estos pacientes. Antes de iniciar el tratamiento con metilfenidato, se debe evaluar adecuadamente a los pacientes con síntomas depresivos comórbidos para establecer si tienen riesgo de padecer un trastorno bipolar; esta evaluación debe incluir una historia psiquiátrica detallada, incluyendo antecedentes familiares de suicidio, trastorno bipolar y depresión. Es fundamental un control continuo y exhaustivo en estos pacientes (ver más arriba “Trastornos psiquiátricos” y sección 4.2). Se deben controlar estos síntomas en los pacientes en cada ajuste de dosis y después, al menos cada 6 meses y en cada visita.
Crecimiento.
Se ha descrito una reducción del aumento de peso corporal y un retraso del crecimiento moderados con el uso prolongado de metilfenidato en niños. Actualmente no se conocen y se están estudiando los efectos de metilfenidato sobre la altura y peso finales.
Se debe controlar el crecimiento durante el tratamiento con metilfenidato: se deben registrar la altura, peso y apetito al menos cada 6 meses en una gráfica de crecimiento.
Puede ser necesario interrumpir el tratamiento en aquellos pacientes que no crezcan o aumenten de peso como se espera.
Convulsiones.
Metilfenidato debe utilizarse con precaución en pacientes con epilepsia. Metilfenidato puede reducir el umbral convulsivo en pacientes con antecedentes de convulsiones, en pacientes con alteraciones del EEG previas en ausencia de convulsiones y raramente, en pacientes sin antecedentes de convulsiones y sin alteraciones en el EEG. Si aumenta la frecuencia de las convulsiones o aparecen convulsiones por primera vez, metilfenidato debe suspenderse.
Abuso, mal uso y tráfico.
Se debe vigilar cuidadosamente a los pacientes por el riesgo de abuso, mal uso o tráfico de metilfenidato.
Metilfenidato debe utilizarse con precaución en pacientes con dependencia conocida a drogas o alcohol por un riesgo potencial de abuso, mal uso o tráfico.
El abuso crónico de metilfenidato puede producir una tolerancia importante y dependencia psicológica, con distintos grados de conducta anormal. Se pueden producir episodios claramente psicóticos, especialmente con el abuso por vía parenteral. Se deben tener en cuenta la edad del paciente, la presencia de factores de riesgo para trastornos de abuso de sustancias (tales como conducta de oposicionista-desafiante o trastorno de conducta y trastorno bipolar comórbidos), el abuso de sustancias previo o actual cuando se decide cursar un tratamiento para el TDAH. Se debe tener precaución en pacientes emocionalmente inestables, tales como aquellos que tengan antecedentes de dependencia de drogas o alcohol, porque estos pacientes pueden aumentarse la dosis por su propia iniciativa.
Para algunos pacientes con alto riesgo de abuso de sustancias, metilfenidato u otros estimulantes pueden no ser adecuados y habrá que valorar un tratamiento con medicamentos no estimulantes.
Retirada.
Se requiere una supervisión cuidadosa durante la retirada del medicamento, ya que esto puede desenmascarar una depresión así como hiperactividad crónica. Algunos pacientes pueden necesitar seguimiento a largo plazo. Se requiere una supervisión cuidadosa durante la retirada del uso abusivo ya que puede aparecer una depresión grave.
Fatiga.
El metilfenidato no debe utilizarse para la prevención o el tratamiento de los estados de fatiga normales.
Elección de la formulación de metilfenidato.
La elección de la formulación del medicamento que contiene metilfenidato debe establecerla el especialista caso por caso y depende de la duración deseada del efecto.
Dopaje.
Este medicamento contiene metilfenidato que puede inducir un falso positivo por anfetaminas en las pruebas de laboratorio, especialmente en el test de inmunoensayo.
Insuficiencia renal o hepática.
Se carece de experiencia en el uso de metilfenidato en pacientes con insuficiencia renal o hepática.
Efectos hematológicos.
La seguridad del tratamiento con metilfenidato a largo plazo no se conoce totalmente. En caso de leucopenia, trombocitopenia, anemia u otras alteraciones, incluyendo aquellas que indiquen trastornos renales o hepáticos graves, se debe considerar la interrupción del tratamiento.
Información importante sobre excipientes:
Este medicamento contiene sacarosa: los pacientes con intolerancia hereditaria a la fructosa, malabsorción de glucosa-galactosa o insuficiencia de sacarosa-isomaltasa, no deben tomar este medicamento.
Interacciones con otros medicamentos de EQUASYM Cáps. dura de liberación modificada 30 mg
Interacción farmacocinética. Se desconoce la influencia del metilfenidato en las concentraciones plasmáticas de los fármacos que se administran concomitantemente. Por lo tanto, se recomienda precaución cuando se combine metilfenidato con otros fármacos, especialmente aquellos con un margen terapéutico estrecho. Metilfenidato no se metaboliza por el citocromo P-450 en un grado clínicamente relevante. No se espera que los inductores o inhibidores del citocromo P-450 tengan un efecto importante en la farmacocinética de metilfenidato.
Los enantiómeros d y l de metilfenidato no inhiben de manera importante el citocromo P-450 1A2, 2C8, 2C9, 2C19, 2D6, 2E1 ó 3A. Sin embargo, se han notificado casos que indican que el metilfenidato puede inhibir el metabolismo de los anticoagulantes cumarínicos, los anticonvulsivantes (como el fenobarbital, la fenitoína o la primidona) y algunos antidepresivos (tricíclicos e inhibidores selectivos de la recaptación de serotonina). Puede ser necesario ajustar la dosis de estos fármacos y vigilar las concentraciones plasmáticas del fármaco (o, en el caso de la cumarina, los tiempos de coagulación) al iniciar o suspender el tratamiento con metilfenidato.
Interacciones farmacodinámicas.
Fármacos antihipertensivos.
Metilfenidato puede disminuir la eficacia de medicamentos utilizados para tratar la hipertensión.
Uso con fármacos que aumentan la presión sanguínea.
Se recomienda precaución al tratar con metilfenidato a pacientes que utilizan cualquier medicamento que también aumente la presión sanguínea (ver también las secciones sobre afecciones cardiovasculares y cerebrovasculares de la sección 4.4 Advertencias y precauciones especiales de empleo). Metilfenidato está contraindicado en pacientes tratados (actualmente o en las 2 semanas anteriores) con inhibidores irreversibles no selectivos de la MAO (ver sección 4.3 Contraindicaciones), por el riesgo de una crisis hipertensiva.
Uso con alcohol.
El alcohol puede exacerbar los efectos adversos sobre el SNC de los fármacos psicoactivos, como metilfenidato. Por tanto, se recomienda que los pacientes se abstengan de consumir alcohol durante el tratamiento.
Uso con anestésicos halogenados.
Hay un riesgo de aumento repentino de la presión sanguínea durante la cirugía. Si se tiene previsto realizar una cirugía, el tratamiento con metilfenidato no debe usarse en el día de la cirugía.
Uso con agonistas alfa 2 de acción central (por ejemplo, clonidina).
Se han notificado efectos adversos graves, incluyendo muerte súbita con el uso concomitante con clonidina. No se ha evaluado de forma sistemática la seguridad del uso de metilfenidato en combinación con clonidina u otros agonistas alfa 2 de acción central.
Uso con fármacos dopaminérgicos.
Se recomienda precaución al administrar metilfenidato con fármacos dopaminérgicos, incluyendo antipsicóticos. Dado que una de las principales acciones de metilfenidato es aumentar los niveles extracelulares de dopamina, metilfenidato se puede asociar con interacciones farmacodinámicas cuando se administra concomitantemente con agonistas dopaminérgicos directos o indirectos (incluyendo DOPA y antidepresivos tricíclicos) o con antagonistas dopaminérgicos incluyendo antipsicóticos.
Embarazo y Lactancia de EQUASYM Cáps. dura de liberación modificada 30 mg
Embarazo.
Hay una cantidad limitada de datos relativos a la utilización de metilfenidato en mujeres embarazadas. Se han notificado casos de toxicidad cardiorrespiratoria neonatal, específicamente taquicardia fetal y distrés respiratorio a través de notificaciones espontáneas. Los estudios en animales solo mostraron toxicidad reproductiva a dosis tóxicas maternas (ver sección 5.3). No se recomienda la utilización de metilfenidato durante el embarazo a menos que se haya tomado una decisión clínica de que retrasar el tratamiento pueda suponer un riesgo mayor para el embarazo.
Lactancia.
Se ha encontrado metilfenidato en la leche materna de una mujer tratada con metilfenidato. Hay una notificación de un niño que sufrió una disminución de peso inespecífica durante el periodo de exposición, pero se recuperó y ganó peso después de que su madre dejara el tratamiento con metilfenidato. No se puede excluir un riesgo para el niño lactante. Se debe decidir, teniendo en cuenta el beneficio de la lactancia para el niño y el beneficio del tratamiento para la mujer, si interrumpir la lactancia o interrumpir/abstenerse del tratamiento con metilfenidato.
Efectos sobre la capacidad de conducción de EQUASYM Cáps. dura de liberación modificada 30 mg
Metilfenidato puede causar mareos, somnolencia y alteraciones visuales incluyendo dificultades de acomodación, diplopía y visión borrosa. Puede tener una influencia moderada en la capacidad para conducir y utilizar máquinas. Se debe advertir a los pacientes de estos posibles efectos y se les debe aconsejar que si se ven afectados por ellos, deben evitar actividades potencialmente peligrosas como conducir o utilizar máquinas.
Reacciones Adversas de EQUASYM Cáps. dura de liberación modificada 30 mg
La siguiente tabla muestra todas las reacciones adversas al medicamento (RAM) observadas en los ensayos clínicos y en las notificaciones espontáneas post-comercialización de Equasym y las que se han notificado con otras formulaciones de metilfenidato hidrocloruro. Si las frecuencias de las reacciones adversas de Equasym y de la otra formulación de metilfenidato eran diferentes, se utilizó la frecuencia más alta de las dos bases de datos. Estimación de frecuencias: muy frecuentes (≥1/10); frecuentes (≥1/100 a <1 a="" datos="" de="" desconocida="" disponibles="" estimarse="" frecuencia="" frecuentes="" los="" muy="" no="" p="" partir="" poco="" puede="" raras="">
Clasificación por órganos y sistemas
|
Reacción adversa
|
Infecciones e infestaciones
| |
Frecuentes:
|
Nasofaringitis
|
Trastornos de la sangre y del sistema linfático
| |
Muy raras:
Desconocida:
|
Anemia, leucopenia, trombocitopenia, púrpura trombocitopénica
Pancitopenia
|
Trastornos del sistema inmunológico
| |
Poco frecuentes:
|
Reacciones de hipersensibilidad tales como edema angioneurótico, reacciones anafilácticas, inflamación auricular, enfermedad bullar, enfermedades exfoliativas, urticaria, pruritos, y erupciones
|
Trastornos del metabolismo y de la nutrición*
| |
Frecuentes:
|
Anorexia, disminución del apetito, reducción moderada en el aumento de peso y altura durante el uso prolongado en niños*
|
Trastornos psiquiátricos*
| |
Muy frecuentes:
Frecuentes:
Poco frecuentes:
Raras:
Muy raras:
Desconocida:
|
Insomnio, nerviosismo
Anorexia, labilidad emocional, agresividad*, agitación*, ansiedad*, depresión*, irritabilidad, comportamiento anormal, bruxismo
Trastornos psicóticos*, alucinaciones auditivas, visuales y táctiles*, ira, ideación suicida*, cambios de humor, humor alterado, intranquilidad, lloro, tics*, empeoramiento de tics preexistentes o síndrome de Tourette*, hipervigilancia, trastornos del sueño
Manía*, desorientación, trastornos de la libido
Intento de suicidio (incluyendo suicidio consumado)*, humor depresivo transitorio*, pensamientos anormales, apatía, comportamientos repetitivos, prestar excesiva atención
Delirios*, trastornos del pensamiento*, estado de confusión, dependencia
|
Se han descrito casos de abuso y dependencia, con más frecuencia con las formulaciones de liberación inmediata (frecuencia no conocida).
| |
Trastornos del sistema nervioso
| |
Muy frecuentes:
Frecuentes:
Poco frecuentes:
Muy raras:
Desconocida:
|
Cefalea
Mareos, discinesia, hiperactividad psicomotora, somnolencia
Sedación, temblor
Convulsiones, movimientos coreoateroides, déficit neurológico isquémico reversible, síndrome neuroléptico maligno (SNM; las notificaciones estaban poco documentadas y en la mayoría de los casos los pacientes también recibían otros medicamentos, así que el papel de metilfenidato no está claro.)
Trastornos cerebrovasculares* (incluyendo vasculitis, hemorragias cerebrales, accidentes cerebrovasculares, arteritis cerebral, oclusión cerebral), convulsiones del gran mal*, migraña
|
Trastornos oculares
| |
Poco frecuentes:
Raras:
|
Diplopía, visión borrosa
Dificultades de acomodación visual, midriasis, alteración visual
|
Trastornos cardiacos*
| |
Frecuentes:
Poco frecuentes:
Raras:
Muy raras:
Desconocida:
|
Arritmia, taquicardia, palpitaciones
Dolor en el pecho
Angina de pecho
Parada cardiaca, infarto de miocardio
Taquicardia supraventricular, bradicardia, extrasístole ventricular, extrasístoles
|
Trastornos vasculares*
| |
Frecuentes:
Muy raras:
|
Hipertensión
Arteritis y/u oclusión cerebral, frío en las extremidades, fenómeno de Raynaud
|
Trastornos respiratorios, torácicos y mediastínicos
| |
Frecuentes:
Poco frecuentes:
|
Tos, dolor faringolaríngeo
Disnea
|
Trastornos gastrointestinales
| |
Frecuentes:
Poco frecuentes:
|
Dolor abdominal, diarrea, náuseas, malestar gástrico y vómitos, boca seca
Estreñimiento
|
Trastornos hepatobiliares
| |
Poco frecuentes:
Muy raras:
|
Aumento de las enzimas hepáticas
Función hepática anormal, incluyendo coma hepático
|
Trastornos de la piel y del tejido subcutáneo
| |
Frecuentes:
Poco frecuentes:
Raras:
Muy raras:
|
Alopecia, prurito, erupción, urticaria
Edema angioneurótico, enfermedad bullar, enfermedades exfoliativas
Hiperhidrosis, erupción macular, eritema
Eritema multiforme, dermatitis exfoliativa, erupción medicamentosa fija
|
Trastornos musculoesqueléticos y del tejido conjuntivo
| |
Frecuentes:
Poco frecuentes:
Muy raras:
|
Artralgia
Mialgia, espasmos musculares
Calambres musculares
|
Trastornos renales y urinarios
| |
Poco frecuentes:
|
Hematuria
|
Trastornos del aparato reproductor y de la mama
| |
Raras:
|
Ginecomastia
|
Trastornos generales y alteraciones en el lugar de la administración
| |
Frecuentes:
Poco frecuentes:
Muy raras:
Desconocida:
|
Pirexia, retraso del crecimiento durante el uso prolongado en niños*
Dolor de pecho, fatiga
Muerte cardiaca súbita*
Malestar torácico, hiperpirexia
|
Exploraciones complementarias
| |
Frecuentes:
Poco frecuentes:
Muy raras:
|
Cambios en la presión sanguínea y en el ritmo cardiaco (generalmente aumento)*, disminución de peso
Murmullo cardíaco*, aumento de las enzimas hepáticas
Aumento de la fosfatasa alcalina en sangre, aumento de bilirrubina en sangre, disminución del recuento plaquetario, recuento de glóbulos blancos anormal
|
*Ver sección 4.4 Advertencias y precauciones especiales de empleo
Sobredosificación de EQUASYM Cáps. dura de liberación modificada 30 mg
La liberación prolongada de metilfenidato de las formulaciones de acción prolongada se debe tener en cuenta al tratar a pacientes con sobredosis.
Signos y síntomas.
La sobredosis aguda, debida fundamentalmente a la sobreestimulación de los sistemas nervioso central y simpático, puede provocar vómitos, agitación, temblores, hiperreflexia, espasmos musculares, convulsiones (pueden ir seguidas de coma), euforia, confusión, alucinaciones, delirio, psicosis, sudoración, sofocos, cefalea, hiperpirexia, taquicardia, palpitaciones, arritmias cardíacas, hipertensión, midriasis y sequedad de las mucosas.
Tratamiento.
No hay un antídoto específico para la sobredosis de metilfenidato.
El tratamiento consiste en proporcionar las medidas de apoyo apropiadas.
Se debe proteger al paciente para evitar que se autolesione y de los estímulos externos que pudieran agravar la sobreestimulación ya presente. Si los signos y síntomas no son demasiado graves y el paciente está consciente se puede evacuar el contenido del estómago provocando el vómito o por lavado gástrico. Antes de realizar el lavado gástrico, se deben controlar la agitación y las convulsiones, si las hay, y proteger la vía aérea. Otras medidas de destoxificación del intestino comprenden la administración de carbón activado y de un catártico. En caso de intoxicación grave, se debe administrar una dosis cuidadosamente ajustada de una benzodiazepina antes del realizar el lavado gástrico. Se deben proporcionar cuidados intensivos para mantener una circulación y un intercambio respiratorio adecuados; en casos de hiperpirexia, puede ser necesario utilizar procedimientos externos para bajar la temperatura. No se ha establecido la eficacia de la diálisis peritoneal o de la hemodiálisis extracorpórea para la sobredosis de metilfenidato.
DATOS FARMACÉUTICOS
Lista de excipientes de EQUASYM Cáps. dura de liberación modificada 30 mg
Contenido de la cápsula:
Esferas de azúcar: Sacarosa. Almidón de maíz. Povidona K29 a K32. Opadry YS-1-7006 claro (hipromelosa, macrogol 400 y macrogol 8000). Dispersión acuosa de etilcelulosa. Sebacato de dibutilo.
Cuerpo de la cápsula:
Gelatina. Dióxido de titanio (E171). Laca de aluminio índigo carmín (E132). 10 mg: Óxido de hierro amarillo (E172). 30 mg: Óxido de hierro rojo (E172).
Tinta de impresión blanca: Goma laca. Propilenglicol. Hidróxido de sodio. Povidona K16. Dióxido de titanio (E171).
Tinta de impresión negra: Barniz de goma laca al 45% (20% esterificado) en etanol. Propilenglicol. Hidróxido de amonio al 28%. Óxido de hierro negro (E172).
Precauciones especiales de conservación de EQUASYM Cáps. dura de liberación modificada 30 mg
Conservar por debajo de 25ºC.
Naturaleza y contenido del recipiente de EQUASYM Cáps. dura de liberación modificada 30 mg
Blíster de PVC/Aclar transparente u opaco con tapa de papel de aluminio y revestimiento de sello de vinilo.
Tamaños de envases: 10 cápsulas duras de liberación modificada; 28 cápsulas duras de liberación modificada;
30 cápsulas duras de liberación modificada; 60 cápsulas duras de liberación modificada; 100 cápsulas duras de liberación modificada (solo 10 mg y 20 mg cápsulas). Puede que solamente estén comercializados algunos tamaños de envases.
Precauciones especiales de eliminación y otras manipulaciones de EQUASYM Cáps. dura de liberación modificada 30 mg
Ninguna especial.
Shire Pharmaceuticals Ireland Limited.
5 Riverwalk.
Citywest Business Campus.
Dublin 24. Irlanda.
E-mail: Medinfoglobal@shire.com
Equasym 10 mg: 76061;
Equasym 20 mg: 76076;
Equasym 30 mg: 76060.
Junio 2012.
Marzo 2012.
11. RÉGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN
Con receta médica. Financiado por el Sistema Nacional de Salud.
12. PRESENTACIÓN, C.N.
Equasym 10 mg, 30 cápsulas duras de liberación modificada. C.N 691359.8.
Equasym 20 mg, 30 cápsulas duras de liberación modificada. C.N 691449.6.
Equasym 30 mg, 30 cápsulas duras de liberación modificada. C.N 691358.1.
Para mayor información diríjase a Shire Pharmaceuticals Ibérica S.L. en el teléfono 91 550 06 91.
Metilfenidato esta indicado como parte de un programa integral para el tratamiento de los niños con TDAH mayores de 6 años, cuando otros remedios por si solos han resultado insuficientes. El tratamiento debe estar supervisado por un especialista en trastornos del comportamiento en niños. Es necesario realizar un screening antes del tratamiento y monitorizar durante el seguimiento. Antes de su prescripción debe consultarse la ficha técnica actualizada del producto.














No hay comentarios:
Publicar un comentario